DCD, Donation after Cardiac Death
Il trapianto è l’unica opzione possibile per molte patologie end-stage. Purtroppo, il numero di donatori idonei al prelievo multiorgano è decisamente inferiore rispetto ai pazienti in lista di attesa. Ciò ha spinto molti paesi, nell’ultimo decennio a sviluppare nuove strategie atte ad espandere il pool di donatori.
Le principali strategie riguardano:
- il miglioramento del trattamento del donatore in morte
encefalica (Brain Death Donor, DBD) attraverso protocolli
di supporto e mantenimento più aggressivi; - l’estensione dei criteri di accettabilità per donatori
considerati marginali; - l’implementazione di protocolli di donazione dopo morte cardiaca da donatori a cuore fermo (Donation after Cardiac Death, DCD).
In Italia il programma “Donation after Cardiac Death (DCD)” è stato avviato nel 2007 a Pavia nella forma “uncontrolled” (il cosiddetto Programma Alba) (1), ovvero nei confronti dei cittadini vittime di arresto cardiaco improvviso, inatteso ed irreversibile.
Nel 2015, a Torino, primo centro italiano, è stato avviato il programma DCD “controlled”, in quei pazienti sottoposti a sospensione dei trattamenti di supporto alle funzioni vitali, considerati clinicamente inappropriati o eticamente sproporzionati. Ad oggi sono molte le Regioni Italiane che partecipano al programma e ogni anno aumenta considerevolmente il numero dei casi segnalati. Tale programma di donazione DCD controllato è stato avviato dal mese di Gennaio 2024 anche nell’AO S.Croce e Carle di Cuneo, dove appunto nel 2024 ci sono state 5 donazioni multiorgano a cuore fermo.
Classificazione DCD
Negli anni Novanta si tenne in Olanda, a Maastricht un workshop internazionale sul tema del donatore DCD, in cui furono proposte diverse categorie di donatori a cuore fermo.
La classificazione originaria di Maastricht è stata modificata in una Consensus Conference a Parigi nel 2013, come riportato in Tabella.

La classificazione più semplice e utile ai fini pratici, distingue i DCD in due categorie:
- Donatori non controllati (uDCD)- categorie II, IV di Maastricht: soggetti con arresto cardiaco improvviso e non prevedibile, trattato con manovre rianimatorie risultate inefficaci; la morte non è prevedibile ed è quindi “non controllata”.
- Donatori controllati (cDCD)- categoria III di Maastricht: pazienti ricoverati in Terapia Intensiva con prognosi infausta, in cui si decide collegialmente con i medici specialisti di sospendere
i trattamenti a sostegno delle funzioni vitali ritenuti non appropriati e futili (ventilazione meccanica, farmaci inotropi e vasopressori, eventuale supporto circolatorio extra-corporeo).
Donazione di organi e tessuti da donatore controllato cDCD
I potenziali donatori cDCD sono pazienti affetti da lesioni cerebrali devastanti ricoverati nei reparti di Terapia Intensiva e con prognosi neurologica infausta, che tuttavia non soddisfano
i criteri neurologici di morte encefalica.
L’équipe medica curante decide collegialmente una sospensione dei trattamenti ritenuti sproporzionati ed inappropriati rispetto al quadro clinico (withdrawal of life sustaining therapy WLST) e la famiglia viene informata esaustivamente della prognosi e della strategia terapeutica. Tra gli obiettivi di cura rientra infatti anche la comunicazione e la relazione d’aiuto con i familiari, che è resa più semplice in un modello di Terapia Intensiva aperta.
La decisione di limitazione terapeutica e di sospensione di terapie di supporto delle funzioni vitali è indipendente dall’eventuale possibilità di donazione di organi. Tale decisione deve essere fondata su criteri di proporzionalità ed appropriatezza, deve essere trasparente, documentata e condivisa. Solo dopo che i curanti hanno formalizzato in cartella il percorso di “desistenza terapeutica”, il Coordinamento ospedaliero delle donazioni di organi e tessuti viene contattato e valuta la possibilità di inserire tali pazienti in un percorso di donazione
a cuore fermo.
Se il paziente in cui è stato pianificato un percorso di limitazione dei trattamenti intensivi non presenta controindicazioni cliniche alla donazione di organi, il Coordinamento ospedaliero esplora la presenza di un’eventuale volontà donativa espressa in vita secondo quanto previsto dalla normativa vigente (L. 91/1999),
mediante interrogazione del Sistema Informativo Trapianti (SIT). In assenza di volontà registrata al SIT, il Coordinamento ospedaliero
coinvolge i familiari aventi diritto in merito alla decisione donativa.
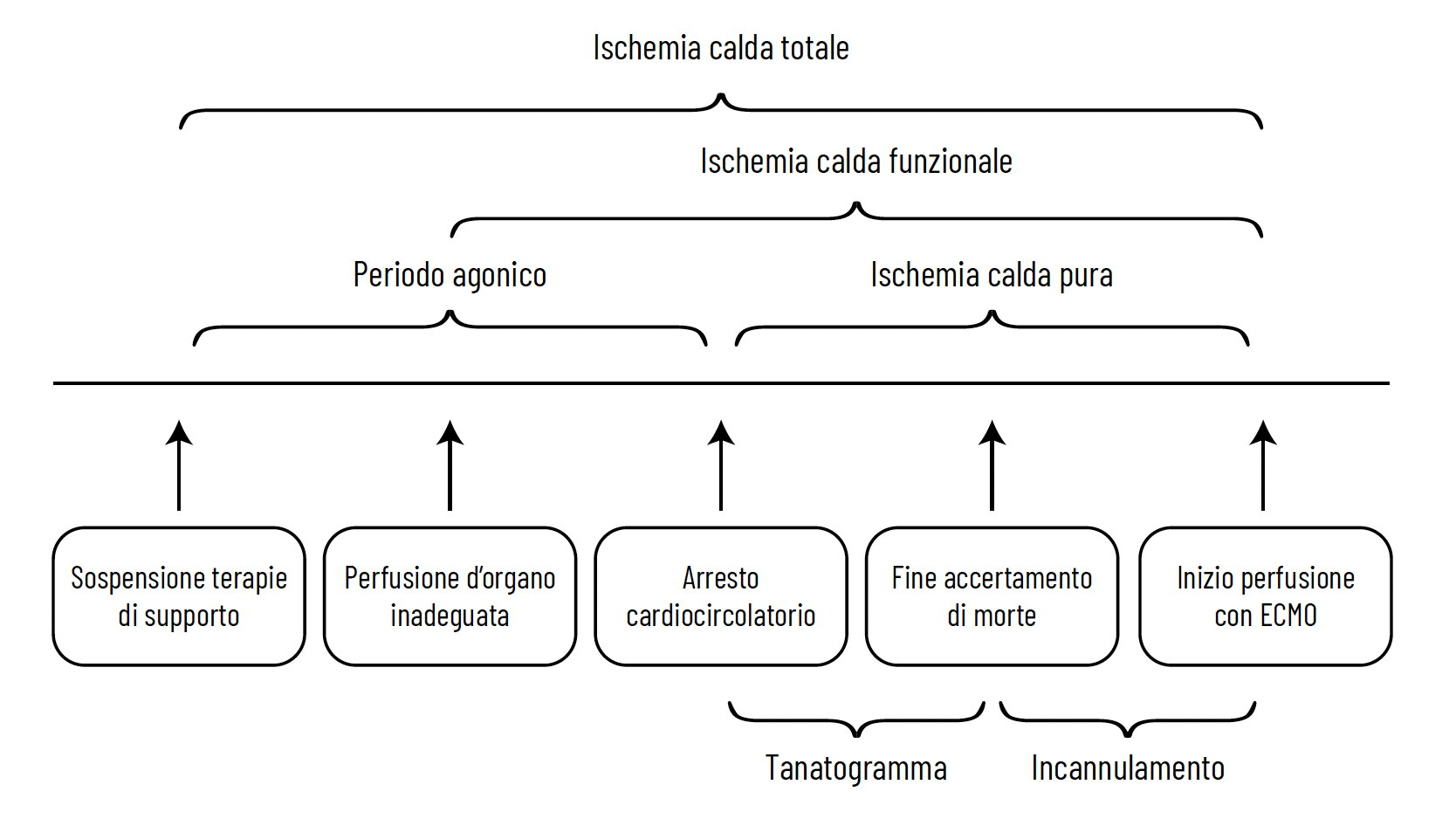
Tempi di ischemia e danno d’organo
Non esiste una definizione univoca di tempo di ischemia calda WIT. In donatori controllati può essere definita come l’intervallo tra la sospensione del trattamento intensivo e l’inizio delle tecniche di perfusione d’organo ed è caratterizzato da una fase di ipotensione che può avere un impatto sostanziale sugli organi prelevati. La durata totale del tempo di ischemia calda non deve essere superiore ai 120 minuti.
L’ischemia calda funzionale” intercorre nel momento in cui si considera realmente inadeguata la perfusione d’organo nel donatore e non dovrebbe superare i 60 minuti totali; essa comprende il periodo in cui la pressione arteriosa sistolica scende al di sotto dei 50 mmHg o la saturazione arteriosa dell’ossigeno al di sotto del 75%, il periodo di accertamento di morte con tanatogramma della durata di 20 minuti secondo la Legge Italiana (no touch-period) è il tempo necessario per avviare la perfusione regionale.
La durata dei 20 minuti è la più lunga al mondo e questo dovrebbe essere a garanzia che l’accertamento di morte sia effettivo.
La differenza tra l’ischemia calda totale (total WIT) e l’ischemia calda funzionale (Functional WIT) dipende dalla durata del periodo agonico, dalle condizioni del donatore e dalle modalità di sospensione dei supporti vitali. La durata del periodo agonico è difficilmente prevedibile.
L’ischemia calda funzionale è responsabile del danno da ischemia e successivamente da riperfusione, la principale causa di graft failure dopo trapianto.
É stato dimostrato dalla letteratura che l’utilizzo di ECMO (Regional Extra Corporeal Membrane Oxygenator) o perfusione regionale normotermica (Normothermic Regional Perfusion, NRP) ha la potenzialità di rendere possibile un certo grado di recupero del danno ischemico e di consentire una valutazione funzionale degli organi addominali (2,3).
La NRP consente di ripristinare i processi metabolici danneggiati e le riserve energetiche funzionali, riparare il danno cellulare e rimuovere i radicali liberi.
La valutazione funzionale del graft durante la perfusione può essere fatta misurando alcuni semplici aspetti:
- il trend dei lattati, espressione del danno ischemico e quindi della perfusione inadeguata,
- il trend delle transaminasi e degli esami di funzionalità renale
- la ripresa della diuresi
Tali parametri, associati alla valutazione macroscopica del graft, alla biopsia e ad un eventuale periodo di perfusione “ex situ” ovvero successivo al prelievo mediante Perfusion Machine sono in grado di stabilire l’idoneità dell’organo e quindi la sua trapiantabilità. La perfusione regionale avviene mediante un circuito extracorporeo attraverso la cannulazione di una vena e di un’arteria femorale per via chirurgica o percutanea; la peculiarità di questa tecnica è che la circolazione è limitata al distretto addominale e ciò viene ottenuto posizionando nell’arteria femorale controlaterale un catetere Fogarty il cui gonfiaggio avviene in aorta sopraceliaca o mediante laparotomia e clampaggio diretto dell’aorta sottodiaframmatica, per impedire la perfusione cardiaca e cerebrale.
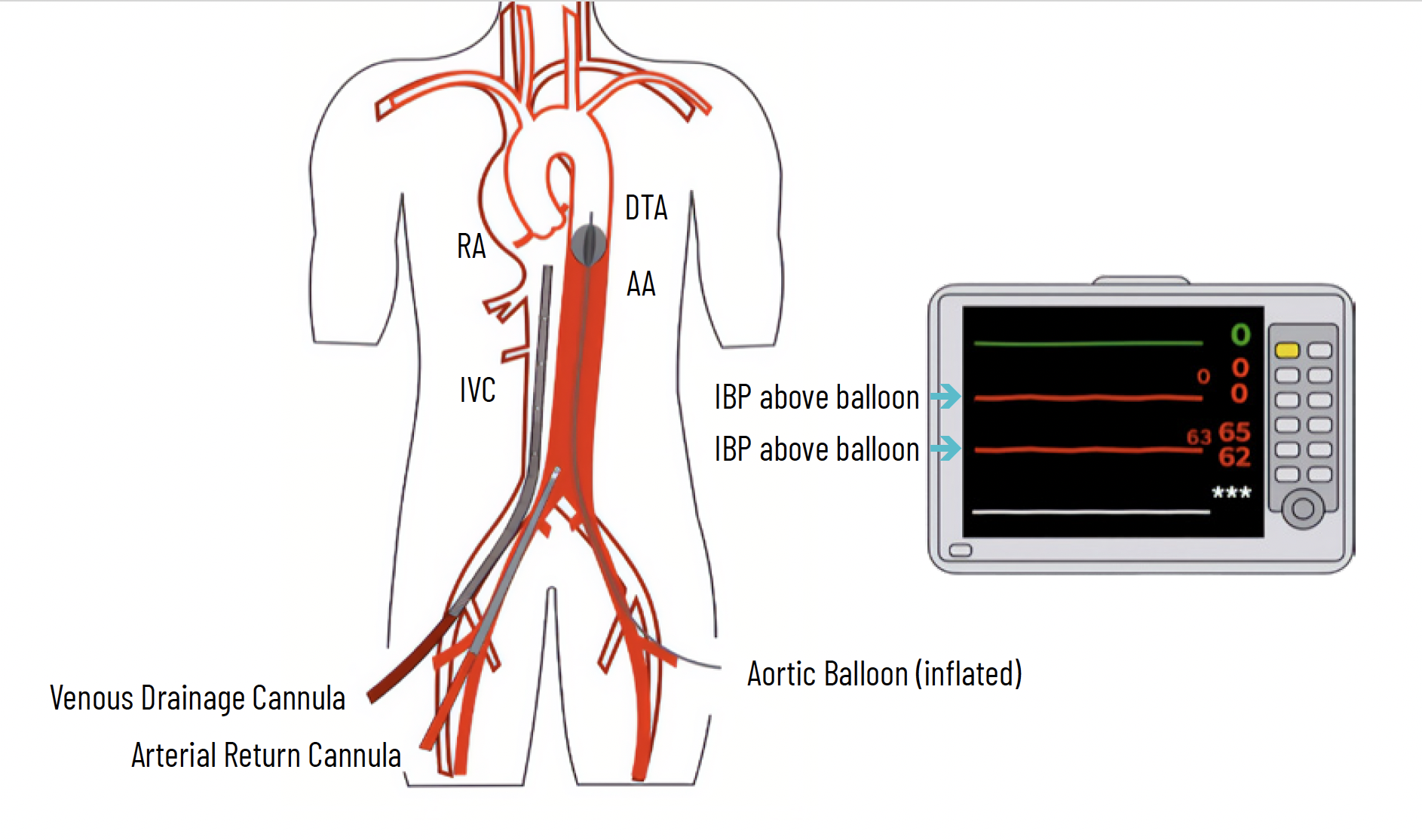
Nel mese di aprile 2023 il Centro Nazionale Trapianti ha pubblicato il documento di indirizzo “Prelievo di cuore combinato con organi addominali da donatore DCD controllato (cDCD)”; tale documento indica i presupposti di natura normativa, etica, clinica ed organizzativa per il prelievo e la valutazione del cuore a scopo di trapianto da donatore dopo arresto cardiocircolatorio “atteso e controllato” (4).
Il trapianto di un cuore prelevato da un donatore “a cuore fermo” è una sfida nella sfida, perché l’organo cardiaco resta fermo per un tempo molto prolungato prima del prelievo e successivamente va di nuovo “riattivato” e irrorato per poter poi essere trapiantato. Dopo il primo DCD cuore eseguito a Padova nel Maggio 2023, sono stati diversi i Centri italiani in cui è stato avviato questo programma, compresa l’AO S.Croce e Carle di Cuneo dove il primo cDCD cuore è stato eseguito nel gennaio 2024 ed un secondo nel febbraio 2025, in cui hanno collaborato le 2 equipe cardiochirurgiche delle Molinette di Torino e del S Croce di Cuneo (5). A differenza di quanto avviene nelle donazioni
a cuore fermo limitate al distretto addominale,
in quest’ultimo caso si procede all’istituzione di una perfusione normotermica toraco-addominale, con esclusione della riperfusione cerebrale mediante clampaggio dei tronchi sovraortici.
La donazione di organi dopo morte cardiaca richiede quindi un’organizzazione e delle competenze tecniche molto elevate, sia da un punto di vista anestesiologico che cardiochirurgico, con una stretta collaborazione e sinergia tra i vari professionisti coinvolti. Il percorso che porta al prelievo inizia tuttavia durante il ricovero nel reparto di Rianimazione, laddove il personale sanitario si prende cura con competenza e delicatezza non solo del paziente ma anche della sua famiglia, avviando una comunicazione puntuale, precisa
e quotidiana. La sensibilità, l’accoglienza e la vicinanza dei sanitari alla famiglia rivestono un ruolo fondamentale nel creare quel rapporto di fiducia che può aprire uno spiraglio verso la donazione.
Perché per ogni donazione si regala una nuova vita a più persone, grazie ad un effetto domino positivo e nobile.
Bibliografia
- Documento del Centro Nazionale Trapianti (CNT) Donazione di Organi a Cuore fermo (DCD) in Italia
Raccomandazioni Operative. Protocollo Alba 2.0 – febbraio 2015 – Fondazione IRCCS Policlinico San Matteo – Pavia - The international experience of in-situ recovery of the DCD heart: a multicentre retrospective observational study. eClinicalMedicine 2023;58: 101887 Published Online https://doi.org/10. 1016/j.eclinm.2023.101887
- Expanding Horizons in Cardiac Transplant: Efficacy and Outcomes of Circulatory and Brain Death Donor
Hearts in a Newly Implemented Cardiac Transplant Program with Limited Donor Accessibility and a Literature Review.
J. Clin. Med. 2024, 13, 4972. https://doi.org/10.3390/jcm13174972 - Come i donatori a cuore fermo e i nuovi protocolli terapeutici stanno cambiando la donazione e il trapianto di cuore.
Rivista Trapianti. 2023, Vol 27, N 4, Ottobre-dicembre - Heart transplantation in controlled donation after circulatory determination of death: the Italian experience.
Ann CardioThorac Surg, 2025;14(1):47-54